Что такое дистилляция спирта. Как отличить дистиллят от ректификата? Какой метод лучше
Дистилляция и ректификация широко используются в промышленности. Этими способами очищают этиловый спирт, из нефти выделяют керосин, бензин, ДТ и прочие компоненты, в парфюмерии получают ароматические вещества и многое другое.
В основу обеих технологий положен один и тот же принцип перегонки жидкости. Тем не менее, различия есть, и довольно серьезные.
Определение, схема устройств и принцип работы
Дистилляция
Дистилляцией называется процесс, в ходе которого жидкость, находящаяся в кубе (емкости) нагревается и испаряется, после чего охлаждается и конденсируется. Пар в итоге может переводиться в жидкость или твердое тело (второй вариант в данной статье не рассматривается). Продукт на выходе называется дистиллят. Или кубовый остаток (так называется жидкость, которая не испарилась), в зависимости от того, с какой целью перегоняли исходную смесь.
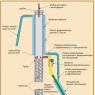
Устройство простейшего аппарата для получения дистиллированной воды. Жидкость находится в кубе 1 с крышкой 2 и термометром 3. После нагрева емкости, вода превращается в пар, который поднимается вверх и попадает в трубку 4 с вентилем 5. А оттуда – в трубку 6, находящуюся в холодильнике 7. Чтобы пар сконденсировался и снова перешел в жидкое состояние, его надо охладить. Для этого трубка 6 омывается проточной ледяной водой. Для повышения эффективности охлаждения, она завита в спираль, чтобы пар дольше находился под действием низкой температуры. Выйдя из холодильника, жидкость попадает в сосуд для сбора дистиллята.
При дистилляции смеси, состоящей из двух компонентов (одним из них является базовая растворяющая жидкость, а второй – в ней растворенный), в пар превращается низкокипящий, то есть тот, у которого более низкая температура кипения. А высококипящий (с более высокой температурой кипения) остается в жидком состоянии. Термометр нужен для регулирования степени нагрева так, чтобы данный параметр находился между указанными температурами.
Отличительной особенностью дистилляции является тот факт, что летучие компоненты испаряются однократно. При таком простом способе невозможно добиться высокой степени разделения составляющих смеси. Кроме того, выделяется только один ингредиент.
Ректификация
 Ректификация – это процесс, на начальном этапе которого жидкость, как и при дистилляции, тоже нагревается и испаряется. Но затем пар попадает в ректификационную колонну. В ней, за счет противотока между жидкой и газообразной фазами смеси, происходит тепловой и массовый обмен между паром и сконденсировавшимися каплями. Исходная смесь делится (притом, с высокой степенью очистки) на компоненты с разными температурами кипения за счет того, что жидкость, фактически, многократно испаряется и конденсируется.
Ректификация – это процесс, на начальном этапе которого жидкость, как и при дистилляции, тоже нагревается и испаряется. Но затем пар попадает в ректификационную колонну. В ней, за счет противотока между жидкой и газообразной фазами смеси, происходит тепловой и массовый обмен между паром и сконденсировавшимися каплями. Исходная смесь делится (притом, с высокой степенью очистки) на компоненты с разными температурами кипения за счет того, что жидкость, фактически, многократно испаряется и конденсируется.
Схема простейшего ректификатора, который можно изготовить даже в домашних условиях. Он состоит из куба, подогреваемого на огне или водяной бане. Над ним расположена ректификационная колонна (в бытовых аппаратах – царга, представляющая собой жесткую трубу) с заполняющими ее насадками (на рисунке называются «мочалки», потому что для домашних устройств их нередко делают из дешевых металлических кухонных мочалок). Над ней – дефлегматор. Сбоку, напротив узла отбора дистиллята, находится специальная отводящая трубка (на схеме окрашена красным). Она соединена с холодильником и далее – с приемной емкостью. В лабораторных и бытовых ректификаторах в качестве «мочалок» применяются насадки, которыми заполняется колонна. Самые популярные: спирально призматическая (Селиваненко) и регулярно проволочная (Панченков). Первая дает самую лучшую степень очистки, вторая, при достаточно эффективной работе, наиболее простая по конструкции. Делаются, обычно, из нержавейки или меди. В промышленных установках вместо насадок применяются специальные тарелки.
 Аппарат работает следующим образом. Исходная смесь нагревается в перегонном кубе и начинает испаряться. Пар проходит через ректификационную колонну. На узле отбора дистиллята часть пара отводится через красную трубку, попадает в холодильник, конденсируется и стекает в приемную емкость. Другая часть поднимается в дефлегматор. Последний представляет собой, по сути, еще один холодильник с проточной водой в рубашке. В нем эта вторая часть пара тоже конденсируется, после чего в виде капель, которые называются флегмой или орошением, стекает в ректификационную колонну и движется внутри нее сверху вниз. Расход воды для охлаждения дефлегматора можно регулировать, тем самым изменяя количество орошения, поступающего обратно в колонну.
Аппарат работает следующим образом. Исходная смесь нагревается в перегонном кубе и начинает испаряться. Пар проходит через ректификационную колонну. На узле отбора дистиллята часть пара отводится через красную трубку, попадает в холодильник, конденсируется и стекает в приемную емкость. Другая часть поднимается в дефлегматор. Последний представляет собой, по сути, еще один холодильник с проточной водой в рубашке. В нем эта вторая часть пара тоже конденсируется, после чего в виде капель, которые называются флегмой или орошением, стекает в ректификационную колонну и движется внутри нее сверху вниз. Расход воды для охлаждения дефлегматора можно регулировать, тем самым изменяя количество орошения, поступающего обратно в колонну.
В ректификационной колонне осуществляется противоток двух фаз – пар поднимается вверх, флегма опускается вниз. Между ними происходит массовый и тепловой обмен, в результате которого пар обогащается низкокипящими (легколетучими) компонентами смеси, а капли стекающей жидкости – высококипящими (труднолетучими) ингредиентами. За счет этого, при достаточной высоте колонны, из верхней ее части (узел отбора дистиллята) выводится целевая фракция большой степени чистоты. Насадки в колонне служат для интенсификации массового и теплового обмена, поскольку конденсация пара осуществляется именно на их развитой поверхности. В промышленных установках это происходит на тарелках.
 Каждая находящаяся в колонне тарелка, называется физической (ФТ). Она нужна для того, чтобы между жидкой и паровой фазами как можно быстрее достигалось состояние равновесия. Пузырьки пара проходят сквозь находящийся на ФТ слой флегмы. В результате ускоряется массовый и тепловой обмен между фазами. Но, после прохождения пара через одну ФТ равновесия еще не будет, потому что КПД данного элемента колеблется в пределах от 50% до 60%. Таким образом, чтобы получить равновесное состояние фаз, которое бы соответствовало одной теоретической тарелке (ТТ), надо поставить две ФТ. Это значит что, если по расчету требуется колонна на 40ТТ, то в действительности в нее надо ставить 80ФТ.
Каждая находящаяся в колонне тарелка, называется физической (ФТ). Она нужна для того, чтобы между жидкой и паровой фазами как можно быстрее достигалось состояние равновесия. Пузырьки пара проходят сквозь находящийся на ФТ слой флегмы. В результате ускоряется массовый и тепловой обмен между фазами. Но, после прохождения пара через одну ФТ равновесия еще не будет, потому что КПД данного элемента колеблется в пределах от 50% до 60%. Таким образом, чтобы получить равновесное состояние фаз, которое бы соответствовало одной теоретической тарелке (ТТ), надо поставить две ФТ. Это значит что, если по расчету требуется колонна на 40ТТ, то в действительности в нее надо ставить 80ФТ.
Установки для ректификации бывают непрерывные и периодические.
В первых жидкая смесь все время подается в колонну, и также постоянно из нее выводятся разделенные ингредиенты. Во вторых в куб сразу загружается определенное количество смеси, после чего аппарат работает до полной ее переработки.
В бытовых устройствах в качестве ректификационной колонны используется царга. Это труба диаметром от 30мм до 50мм, заполненная по всему объему насадками. Чтобы последние не высыпались, по краям ставят проницаемые для пара и капель пыжи. Состояние равновесия фаз достигается в том случае, когда пар проходит через некоторый слой царги, эквивалентный одной ТТ. Его высоту рассчитывают в миллиметрах и называют высотой единицы переноса.
Главные особенности ректификации: выделение нужного ингредиента в чистом виде и возможность разделения исходной смеси сразу на несколько компонентов. Чем выше колонна, тем медленнее идет процесс, но тем чище конечный продукт.
Процессы в виноделии
В отрасли изготовления алкогольных напитков, разница между дистиллированным и ректифицированным спиртом объясняется следующим образом. Дистиллят – это сырье, в котором остается органолептика (вкус и запах) исходного продукта. То есть, если делается напиток зерновой, то зерна, если яблочный – яблока и так далее. При этом в дистиллированном этиловом спирте еще есть множество примесей. Часть из них формируют вкус и запах. От прочих избавляются с помощью различных рецептов. Ректификат – это рафинированно очищенный спирт. Органолептика исходного продукта полностью отсутствует. В нем вкус и запах только спирта, и больше – ничего. На следующих стадиях технологического процесса, с помощью вкусовых добавок и ароматизаторов, в него вносят заданную органолептику, после чего получают широкий ассортимент наливок, настоек и прочего.
Исходя из этого, нельзя говорить, что один способ лучше, а другой – хуже. У каждого свое предназначение. Если, например, делается бренди со вкусом и ароматом винограда, то нужна дистилляция. После ректификации указанные особенности исчезнут. Для получения приятного аромата, дистиллированный спирт выдерживают в дубовых бочках. А для ректифицированного 96%-го спирта это бесполезно, он годится лишь для разведения, например, при изготовлении водки. К этому еще можно добавить, что оборудование для ректификации спирта стоит дороже, чем для дистилляции. К тому же, для проведения ректификации требуется дистиллированная брага.
Теоретические основы дистилляции
В смеси, состоящей из двух ингредиентов (одним из которых является жидкость, как основа раствора), концентрация растворенного вещества в жидкости С1 отличается от концентрации С2 его же в паре этой жидкости. Коэффициент разделения (распределения)
является характеристикой процесса. В некоторых случаях удобней работать с обратной величиной: А = 1 / В, которая называется так же. Данный параметр зависит от условий проведения дистилляции и природы веществ, составляющих смесь.
В зависимости от условий, коэффициент В может быть:
Идеальный. На него влияют только парциальные давления ингредиентов смеси (парциальным называется давление отдельно взятого газа, входящего в смесь из нескольких газов; то есть, это давление одного газа, которое у него было бы, если бы он занимал весь объем, который занимает смесь газов).
Равновесный. В этом случае число молекул газа Н, улетучивающихся из жидкости, равно числу его молекул Н1, которые возвращаются в жидкость за то же время.
Эффективный.
На практике на проведение дистилляции влияют перемешивание раствора и наличие в нем примесей. Присутствие последних может оказаться настолько значительным, что по разделению основного вещества и примесей эффективный коэффициент может очень сильно отличаться от идеального.
Не менее важными параметрами процесса являются температура испарения и степень отклонения системы от фазового равновесия между жидкостью и паром. Во время дистилляции:
Где НС – число молекул, переходящих в конденсат. Количественно отклонение определяется соотношением: НС / Н. В этом случае есть два предельных состояния системы. Если НС = 0, то имеет место равновесие, сколько частиц ушло из жидкости за единицу времени, столько же в нее и вернулось. Если НС = Н, то это молекулярная дистилляция, то есть, все частицы, испарившиеся из жидкости, перешли в конденсат. Обычно такое бывает, если процесс проводится в вакууме, давление пара небольшое, а расстояние от поверхности воды до точки конденсации минимальное. В этом случае частицы пара не сталкиваются, ни с молекулами воздуха, ни между собой.
Виды дистилляции
Описанный в начале статьи процесс, при котором жидкость нагревается и частично испаряется, а ее пары непрерывно отводятся в холодильник и там конденсируются, называется простой перегонкой. При работе с многокомпонентной жидкой смесью, применяется дробная перегонка или фракционная дистилляция. В этом случае ингредиенты смеси собирают в конденсат по частям, в зависимости от их летучести, начиная с самого низкокипящего.
Ректификация многими специалистами считается разновидностью дистилляции. Она происходит за счет того, что любая замкнутая система, состоящая из газа и жидкости, стремится к состоянию равновесия. А при ректификации рабочая (фактическая) концентрация ингредиентов паровой фазы отличается от той, которая должна быть, чтобы данная жидкость находилась в равновесии.
Дистилляция и ректификация – это два способа разделения компонентов жидкой смеси, в основе которых лежит один и тот же физический процесс. Но разные технологии их проведения позволяют получить на выходе совершенно различные результаты.
Первые упоминания о процессе дистилляции можно отнести к 1 тысячелетию до нашей эры. Аристотель - один из первых ученых, кто полностью описал эту технологию. Позже и различные алхимики со всего мира занимались этим процессом. Можно найти упоминания о перегонке спирта у многих народностей, пользующихся сырьем из винограда, сахарного тростника, яблочного сока, слив и многого другого. Египетские алхимики внесли существенный вклад в развитие дистилляции. Они придерживались мнения, что, благодаря перегонке, из вина можно выделить "душу", а в русской терминологии "спиритус" был упрощен до слова "спирт". Ниже мы поговорим о данном явлении и узнаем, что такое это - дистилляты.
Что такое дистилляция
С латинского языка это означает "стекание каплями". Данная технология является ни чем иным, как перегонкой жидкости, в результате чего она испаряется, превращаясь в пар при охлаждении после контакта с воздухом. Дистилляцию разделяют на 2 вида:
- С конденсацией пара в жидкость.
- С конденсацией пара в твердую фазу.
Таким образом, дистилляты - это полученная жидкость или твердое вещество (иначе его называют остаток), полученное в результате конденсата. Помимо этого, дистилляцию разделяют на простую и фракционную. В первом варианте - это непрерывный отвод и испарение жидкости, а второй метод предполагает проведение перегонки с различными температурами, и каждый отвод уходит на отдельную колбу.
Для проведения данного процесса необходимы основные элементы:
- обогреваемая закрытая емкость (куб, контейнер);
- каплеуловитель (труба для устранения уноса брызг);
- охлаждаемый конденсатор (холодильник);
- конденсатор в (труба в трубе);
- паропровод (или змеевик), соединяющий оба элемента;
- приемная емкость.

Для чего используют дистилляцию
Это нужно, когда есть необходимость разделить жидкость на несколько фракций или отделить от примесей. Это касается эфирных масел, воды, гидролатов, цветочной воды, алкоголя и нефтепромышленности. Важно помнить, что соблюдение мер безопасности является ключевым моментом протекания дистилляции.
Обычную питьевую воду подвергают данной технологии для ее очистки. На выходе мы получаем чистую воду без различных примесей. Соли, металлы, микроорганизмы, песок и прочее оседают в кубе, подогреваемом с жидкостью. А конденсат дистиллята избавлен от этих добавок.
Но самая востребованная причина дистилляции - это спиртовая перегонка. В результате нее получают спиртовой продукт. Получается, что такие спиртосодержащие напитки - это дистилляты.
Этапы протекания технологии
Если говорить простым языком, то для получения конечного спиртосодержащего продукта необходимо провести технологию в 3 этапа испарения жидкости.

В плотно закрытой (герметичной) емкости помещена брага (спиртосодержащая основа), которая при нагревании начинает конденсировать при прохождении через змеевик. Первая (или "головная") фракция испарения является самой легкой и в ней содержится Вдыхать и пить его нельзя, так как от него получают сильнейшую интоксикацию, от которой слепнут и умирают.
Вторая фракция (или как ее еще называют "средний дистиллят") - этиловый спирт, именно он и является целью спиртовой дистилляции. Под конец из змеевика капает обычная вода, почти лишенная спирта, но в ней присутствуют тяжелые металлы (бутанол и изопропанола), которые тоже ядовиты, но не как метанол, - несут тяжелое похмелье. Эту фракцию называют "хвостовой". Процесс прекращают тогда, когда дистиллят перестает гореть.
Получается, что "золотая середина" спирта - дистиллята является целью получения элитного алкогольного напитка. К примеру, коньяк, арманьяк, кальвадос, шотландский и ирландский виски, испанский и португальский бренди, мексиканская текила и многие другие изготавливаются именно по этой традиционной технологии спиртовой дистилляции.
Дистиллят - это не просто очищенная жидкость от примесей, это сохранность вкусовых качеств. Особенностью дистилляции является то, что полностью избавиться от примесей невозможно из-за летучести компонентов. Но именно благодаря этому качеству алкогольные напитки сохраняют свой неповторимый ароматный вкус. К примеру, если 100-летнее шотландское виски подвергнуть ректификации (более точное разделение фракций, более чистый спирт), то по вкусу от водки ничем отличаться не будет.

Дистиллят газового конденсата (ДГК)
Это прозрачная жидкость, которая образуется в результате перегонки природных газов и не растворяется в воде. В состав них входят бензиновые, керосиновые фракции без смолистых веществ. Другими словами, это продукт нефтепереработки. Его применяют в качестве или растворителя в лакокрасочной промышленности.

Эти дистилляты разделяются на легкий, средний и тяжелый ДГК. Самый популярный из них используют в нефтяной промышленности в виде добавок в получении бензина, топлива, это легкий ДГК.
Средний дистиллят близок по своему составу к зимним маркам дизельного топлива. Тяжелый - это остаточные фракции перегонки и применяются на технологических установках, котельных в качестве топлива.
Применение и транспортировка ДГК
Нефтехимический дистиллят - это взрывоопасное и взрывчатое вещество. Транспортировка вещества осуществляется с соблюдением строжайших требований безопасности в герметичных емкостях из антикоррозийного покрытия.
Из него изготавливают также некоторые виды полимерных материалов, при соответствующей химической очистке и стабилизации дистиллята. А также в производстве присадок с высоким значением октанового числа и выступает сырьевым материалом для синтеза олефинов. Прекрасно справляется с жирными пятнами на машинных механизмах и выступает в качестве растворителя в лакокрасочной промышленности.

В заключение о дистиллятах
Дистиллят - это продукт, полученный в результате физико-химического процесса, называемого дистилляцией. Технология несложная, но требует соблюдения безопасности и четкого выполнения последовательных действий. На протекание процессов влияет множество факторов, проводить перегонку стоит только при наличии специальных знаний и навыков.
Различают дистилляцию с конденсацией пара в жидкость (при которой получаемый дистиллят имеет усреднённый состав вследствие перемешивания) и дистилляцию с конденсацией пара в твёрдую фазу (при которой в конденсате возникает распределение концентрации компонентов). Продуктом дистилляции является дистиллят или остаток (или и то, и другое) - в зависимости от дистиллируемого вещества и целей процесса. Основными деталями дистилляционного устройства являются обогреваемый контейнер (куб) для дистиллируемой жидкости, охлаждаемый конденсатор (холодильник) и соединяющий их обогреваемый паропровод.
Энциклопедичный YouTube
1 / 4
✪ 7.4.Дистилляция часть-4 вторичная дробная дистилляция
✪ Вакуумная дистилляция Часть 1
✪ 7.2. Дистилляция часть-2 первичная дистилляция
✪ 7.3. Дистилляция часть-3 первичная дистилляция
Субтитры
История
Первые сведения о дистилляции относятся к I веку и упоминаются в работах греческих алхимиков в Александрии (Египет) . В XI веке, у Авиценны , дистилляция упоминается как метод получения эфирных масел . C середины XIX века разрабатывается ректификация .
Применение
Теория дистилляции
В теории дистилляции в первую очередь рассматривается разделение смесей двух веществ . Принцип дистилляции основан на том, что концентрация некоторого компонента в жидкости отличается от его концентрации C 2 {\displaystyle C_{2}} в паре этой жидкости. Отношение β {\displaystyle \beta } = C 2 / C 1 {\displaystyle C_{2}/C_{1}} является характеристикой процесса и называется коэффициентом разделения (или распределения) при дистилляции. (Также коэффициентом разделения при дистилляции называют величину α=1/β). Коэффициент разделения зависит от природы разделяемых компонентов и условий дистилляции. В зависимости от условий дистилляции различают идеальный (определяемый только парциальными давлениями паро́в чистых компонентов), равновесный (когда число частиц, покидающих в единицу времени жидкость, равно числу частиц, возвращающихся в это же время в жидкость) и эффективный коэффициенты разделения. Практически дистилляция веществ сильно зависит от интенсивности перемешивания жидкости, а также от взаимодействия примесей с основным компонентом и с другими примесными компонентами с образованием соединений (в связи с чем дистилляция считается физико-химическим процессом). Эффективный коэффициент разделения смеси «основное вещество - примесь» может на несколько порядков отличаться от идеального коэффициента разделения.
Режимы дистилляции характеризуются температурой испарения и степенью отклонения от фазового равновесия жидкость-пар. Обычно в дистилляционном процессе n=+, где n - число частиц вещества, переходящих в единицу времени из жидкости в пар, n 1 {\displaystyle n_{1}} - число частиц, возвращающихся в это же время из пара в жидкость, n c {\displaystyle n_{c}} - число частиц, переходящих в это время в конденсат. Отношение n c {\displaystyle n_{c}} /n является показателем отклонения процесса от равновесного. Предельными являются режимы, в которых n c {\displaystyle n_{c}} =0 (равновесное состояние системы жидкость-пар) и n c {\displaystyle n_{c}} =n (режим молекулярной дистилляции).
Идеальный коэффициент разделения двухкомпонентного вещества может быть выражен через давления p 1 0 {\displaystyle p_{1}^{0}} и p 2 0 {\displaystyle p_{2}^{0}} чистых компонентов при температуре процесса: β i {\displaystyle \beta _{i}} = p 2 / p 1 {\displaystyle p_{2}/p_{1}} . С учётом коэффициентов активности компонентов γ 1 {\displaystyle \gamma _{1}} и γ 2 {\displaystyle \gamma _{2}} , отражающих взаимодействие компонентов в жидкости, равновесный коэффициент β = γ 2 p 2 0 / γ 1 p 1 0 {\displaystyle \beta =\gamma _{2}p_{2}^{0}/\gamma _{1}p_{1}^{0}} . Коэффициенты активности имеют температурную и концентрационную зависимости (см. активность (химия)). С понижением температуры значение коэффициента разделения обычно удаляется от единицы, то есть эффективность разделения при этом увеличивается.
При n c {\displaystyle n_{c}} =n все испаряющиеся частицы переходят в конденсат (режим молекулярной дистилляции). В этом режиме коэффициент разделения β m = β M 1 / M 2 {\displaystyle \beta _{m}=\beta {\sqrt {M_{1}}}/{\sqrt {M_{2}}}} , где M 1 {\displaystyle M_{1}} и M 2 {\displaystyle M_{2}} - молекулярные массы первого и второго компонентов соответственно. Определение молекулярного режима дистилляции возможно по величине N=h/(Kλ), где h - расстояние от испарителя до конденсатора, λ - длина свободного пробега молекул дистиллируемого вещества, K - константа, зависящая от конструкции аппарата. При N<0,25 наблюдается молекулярное испарение, при N>4 между жидкостью и паром устанавливается динамическое равновесие, а при других значениях N испарение имеет промежуточный характер. Режим молекулярной дистилляции может применяться в различных дистилляционных способах, включая ректификацию . Обычно молекулярная дистилляция осуществляется в вакууме при низком давлении пара и при близком расположении поверхности конденсации к поверхности испарения (что исключает столкновение частиц пара друг с другом и с частицами атмосферы). В режиме, близком к молекулярной дистилляции, проводится дистилляция металлов. В связи с тем, что коэффициент разделения при молекулярной дистилляции зависит не только от парциальных давлений компонентов, но и от их молекулярных (или атомных) масс, молекулярная дистилляция может применяться для разделения смесей, для которых β=1, - азеотропных смесей , включая смеси изотопов .
Для различных режимов дистилляции выведены уравнения, связывающие содержание второго компонента в конденсате C / C 0 {\displaystyle C/C_{0}} и в остатке с долей перегонки G / G 0 {\displaystyle G/G_{0}} или с долей остатка при заданных условиях процесса и известной начальной концентрации жидкости ( G {\displaystyle G} , G 1 {\displaystyle G_{1}} и G 0 {\displaystyle G_{0}} - масса конденсата и остатка, а также начальная масса дистиллируемого вещества соответственно). Расчёты проводятся в предположении идеального перемешивания дистиллируемой жидкости, а также жидкого конденсата. Также выведены уравнения распределения компонентов в твёрдом конденсате, получаемого дистилляцией с направленным затвердеванием конденсата или зонной дистилляцией. Параметром этих уравнений является коэффициент разделения β для заданных условий дистилляции.
При дистилляции вещества с большой концентрацией компонентов с конденсацией пара в жидкость при несильной зависимости коэффициентов активности компонентов от их концентраций взаимосвязь величин G 1 / G 0 {\displaystyle G_{1}/G_{0}} , C 1 {\displaystyle C_{1}} и C 0 {\displaystyle C_{0}} , когда используются концентрации в процентах, имеет вид:
L g G 1 G 0 = 1 β − 1 l g C 1 C 0 − β β − 1 l g 100 − C 1 100 − C 0 {\displaystyle lg{\tfrac {G_{1}}{G_{0}}}={\tfrac {1}{\beta -1}}lg{\tfrac {C_{1}}{C_{0}}}-{\tfrac {\beta }{\beta -1}}lg{\tfrac {100-C_{1}}{100-C_{0}}}} .
Для дистилляции с конденсацией пара в жидкость при малом содержании примеси
C / C 0 = 1 − (1 − G / G 0) β G / G 0 {\displaystyle C/C_{0}={\tfrac {1-(1-G/G_{0})^{\beta }}{G/G_{0}}}} ,
C 1 / C 0 {\displaystyle C_{1}/C_{0}} = (G 1 / G 0) β − 1 {\displaystyle (G_{1}/G_{0})^{\beta -1}} ,
где β - отношение концентраций примеси в паре и в жидкости.
Приведённые дистилляционные уравнения описывают не только процессы равновесия компонентов в системах газ-жидкость, но и при описании распределения компонентов двух контактирующих фаз при интенсивном перемешивании (например, переходы жидкий кристалл-кристалл, жидкий кристалл-жидкость, газ-плазма, а также в переходах, связанных с квантово-механическими состояниями - сверхтекучая жидкость , конденсат Бозе - Эйнштейна) - при подстановке в них соответствующих коэффициентов разделения. Зачастую они пригодны для теоретического описания сублимации - прежде всего, при температуре вблизи температуры плавления.
Дистилляция с конденсацией пара в жидкость
Простая перегонка - частичное испарение жидкой смеси путём непрерывного отвода и конденсации образовавшихся паров в холодильнике. Полученный конденсат называется дистиллятом, а неиспарившаяся жидкость - кубовым остатком.
Фракционная дистилляция (или дробная перегонка) - разделение многокомпонентных жидких смесей на отличающиеся по составу части, фракции, путём сбора конденсата частями с различной летучестью, начиная с первой, обогащенной низкокипящим компонентом. Остаток жидкости обогащён высококипящим компонентом. Для улучшения разделения фракций применяют дефлегматор .
Ректификация - способ дистилляции, при котором часть жидкого конденсата (флегма) постоянно возвращается в куб, двигаясь навстречу пару в колонне . В результате этого примеси, содержащиеся в паре, частично переходят во флегму и возвращаются в куб, при этом чистота пара (и конденсата) повышается.
Дистилляция с конденсацией пара в твёрдую фазу
Дистилляция с конденсацией пара в градиенте температуры - дистилляционный процесс, в котором конденсация в твёрдую фазу осуществляется на поверхности, имеющей градиент температуры, с многократным реиспарением частиц пара. Менее летучие компоненты осаждаются при более высоких температурах. В результате в конденсате возникает распределение примесей вдоль температурного градиента, и наиболее чистая часть конденсата может быть выделена в качестве продукта. Разделение компонентов пара при реиспарении подчиняется собственным закономерностям. Так, при молекулярной дистилляции соотношение между количествами Q 1 {\displaystyle Q_{1}} и Q 2 {\displaystyle Q_{2}} осаждённых в конденсаторе первого и второго компонентов, соответственно, выражается равенством:
Q 1 / Q 2 = (μ η 1 W 1 0 − W 1) / (μ η 2 W 2 0 − W 2) {\displaystyle Q_{1}/Q_{2}=(\mu \eta _{1}W_{1}^{0}-W_{1})/(\mu \eta _{2}W_{2}^{0}-W_{2})} ,
где W 1 0 {\displaystyle W_{1}^{0}} и W 1 {\displaystyle W_{1}} - скорости испарения первого компонента из расплава и с поверхности реиспарения соответственно, W 2 0 {\displaystyle W_{2}^{0}} и W 2 {\displaystyle W_{2}} - то же для второго компонента, η 1 {\displaystyle \eta _{1}} и η 2 {\displaystyle \eta _{2}} - коэффициенты конденсации первого и второго компонентов соответственно, μ - коэффициент, зависящий от поверхности испарения и углов испарения и реиспарения. Реиспарение повышает эффективность очистки от трудноудаляемых малолетучих примесей в 2-5 раз, а от легколетучих - на порядок и более (по сравнению с простой перегонкой). Этот вид дистилляции нашёл применение в промышленном производстве высокочистого бериллия.
Дистилляция с направленным затвердеванием конденсата (дистилляция с вытягиванием дистиллята) - дистилляционный процесс в контейнере удлинённой формы c полным расплавлением дистиллируемого вещества и конденсацией пара в твёрдую фазу по мере вытягивания конденсата в холодную область. Процесс разработан теоретически.
В получаемом конденсате возникает неравномерное распределение примесей, и наиболее чистая часть конденсата может быть выделена в качестве продукта. Процесс является дистилляционным аналогом нормальной направленной кристаллизации. Распределение примеси в конденсате описывается уравнением:
C / C 0 = β (1 − x / L) β − 1 {\displaystyle C/C_{0}=\beta (1-x/L)^{\beta -1}} ,
где С - концентрация примеси в дистилляте на расстоянии х от начала, L - высота конденсата при полностью испарившемся дистиллируемом материале.
Зонная дистилляция - дистилляционный процесс в контейнере удлинённой формы c частичным расплавлением рафинируемого вещества в перемещаемой жидкой зоне и конденсацией пара в твёрдую фазу по мере выхода конденсата в холодную область. Процесс разработан теоретически.
При движении зонного нагревателя вдоль контейнера сверху вниз в контейнере формируется твёрдый конденсат с неравномерным распределением примесей, и наиболее чистая часть конденсата может быть выделена в качестве продукта. Процесс может быть повторён многократно, для чего конденсат, полученный в предыдущем процессе, должен быть перемещён (без переворота) в нижнюю часть контейнера на место рафинируемого вещества. Неравномерность распределения примесей в конденсате (то есть эффективность очистки) растёт с увеличением числа повторений процесса.
Зонная дистилляция является дистилляционным аналогом зонной перекристаллизации. Распределение примесей в конденсате описывается известными уравнениями зонной перекристаллизации с заданным числом проходов зоны - при замене коэффициента распределения k для кристаллизации на коэффициент разделения α для дистилляции. Так, после одного прохода зоны
C / C 0 = 1 − (1 − β) e x p (− β {\displaystyle C/C_{0}=1-(1-\beta)exp(-\beta } x / λ) {\displaystyle x/\lambda)} ,
где С - концентрация примеси в конденсате на расстоянии х от начала конденсата, λ - длина жидкой зоны.
Девятых Г. Г., Еллиев Ю. Е. Введение в теорию глубокой очистки веществ. - М.: Наука, 1981. - 320 с.Дистилляция (от лат. distillatio - стекание каплями) - перегонка, разделение жидких смесей на отличающиеся по составу фракции. Процесс основан на различии температур кипения компонентов смеси.
Хорошо всем известный пример использования дистиллированной воды - заливка в аккумуляторы автомобиля. В быту же дистилляторы не нашли широкого применения.
И дело здесь совсем не в непригодности дистиллированной воды для питья. Вредность такой воды из-за отсутствия в ней «полезных» минеральных веществ - это, скорее, укоренившийся предрассудок. Дистиллированная вода действительно имеет невысокие вкусовые качества, часто ее вкус характеризуют как «затхлый». Однако с точки зрения влияния на здоровья нет никаких свидетельств того, что дистиллированная вода непригодна для питья.
Ограниченность же применения дистилляторов в быту объясняется следующими причинами:
Во-первых, бытовые дистилляторы имеют малую производительность (около одного литра в час).
Во-вторых, в бойлере дистиллятора постоянно образуются осадок, накипь и т.п., которые надо вычищать.
В-третьих, дистилляторы излучают тепло и в довольно значительных количествах.
В-четвертых, дистилляторы потребляют значительное количество электроэнергии, что для многих применений делает их использование менее рентабельным, чем обратный осмос (способ очистки воды, при котором вода, проходит через специальную полупроницаемую мембрану) или деминерализация на ионообменных смолах.
В результате дистилляции мы получаем самогон, а не спирт. Даже после многократных перегонок в нем все равно останется немного сивушных масел и других примесей. Сейчас в продаже есть ректификационные колонны, и делать чистый спирт дома стало легко. Так почему самогонщики продолжают выбирать дистилляторы?
Дистилляция – это испарение жидкостей (например, спиртосодержащей браги), охлаждение и конденсация пара. Ректификация – это отделение спирта в процессе многократного теплообмена между спиртосодержащими жидкостью и паром. В процессе дистилляции мы получаем самогон – более или менее крепкую жидкость, содержащую спирт, воду и небольшое количество примесей. В процессе ректификации мы получаем чистый спирт практически без примесей.
Дистиллят, даже самый чистый, содержит примеси. В ректификате примесей практически нет.
Казалось бы, чистый спирт всегда лучше. Для того и занимаемся самогоноварением, чтобы пить чистые напитки. Спирт можно разбавить и получить водку, можно настоять на ягодах или травах. Значит, делаем простейшую сахарную брагу, строим , гоним спирт и используем как основу для приготовления напитков без сивушных масел и ацетона. И будет нам счастье.
На основе ректификата можно готовить водку, наливки, настойки и ликеры.
Но не все так просто. Возьмем, например, коньяк – ароматный напиток, сделанный методом возгонки из виноградного вина. Откуда берется его аромат? Это и есть сивушные масла, изначально содержащиеся в вине. Если вино ректифицировать, отобрав все примеси, мы получим очень чистый, но безликий спирт. Если вино дистиллировать, сохранив в процессе перегонки ароматические вещества, получится основа для приготовления коньяка. Конечно, ее еще нужно выдержать в специально подготовленной , но главное – основа из правильного материала. Из спирта-ректификата “коньяк” можно получить, только добавив .
Примеси – это не только опасный метанол, но и ароматические вещества, которые создают запах коньяка или виски.
Конечно, для приготовления хорошего коньяка дистиллят все равно требуется очищать от головной фракции, в которой не содержится ничего вкусного и полезного. И начать отбор хвостовой фракции для хорошнего результата тоже нужно вовремя. В городе Коньяк во Франции этим занимаются настоящие мастера дистилляции, тонко чувствующие, когда отобрать самую лучшую часть дистиллята. Но и простой смертный может научиться этому, если будет настойчив в пробах.
Со временем винокур приобретает необходимый опыт и отбирает питейную часть, отсекая все вредное и сохраняя аромат зерна, яблок или винограда в напитке.
Выводы. Выбор оборудования сводится к выбору между напитками. Что вы больше любите – виски или водку? Кальвадос или абсент? Чачу или наливки? Если вы везде выбрали первое – вам нужен дистиллятор. Для второго берите ректификационную колонну. Ваш Алковод.